'디아세레인' 제제 투여금기 환자 대상에 간질환을 가지고 있거나 경력이 있는 환자가 추가된다.
기존 허가사항에는 중증의 간부전 환자가 투여금기 대상이었지만, 간질환을 가지고 있거나 경력이 있는 환자로 확대 반영된다.
'디아세레인' 제제 '신중투여 대상 환자' 항목의 경우 '고령자'에서 '65세 이상의 고령자'로 변경된다.
26일 식품의약품안전처에 따르면, '디아세레인' 제제 품목허가(신고) 사항이 약사법 '제76조 제1항 단서 조항, '의약품 등의 안전에 관한 규칙'(총리령) 제8조 제3항 제5호 등 규정에 의거해 지난 9일 변경 지시됐다. 허가사항 변경대상 제제는 동국제약 '디레인캡슐' 등 31개 품목이다
메디컬헤럴드 신문이 식약처의 '디아세레인 단일제 허가사항 변경대비표'<下 표 참조>를 확인한 결과, '디아세레인' 제제 투여금기 환자 대상에 '간질환을 가지고 있거나 경력이 있는 환자'가 추가된 것으로 나타났다.
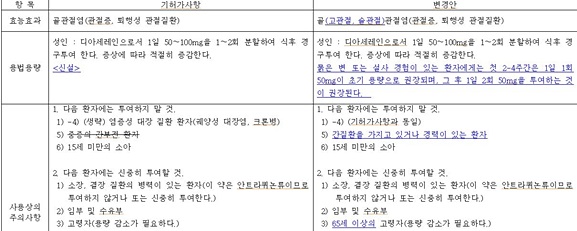
디아세레인 허가사항 '용법 용량' 항목에 "묽은 변 또는 설사 경험이 있는 환자에게는 첫 2-4주간은 1일 1회 50mg이 초기 용량으로 권장되며, 그 후 1일 2회 50mg을 투여하는 것이 권장된다"는 내용이 신설된다.
'디아세레인' 제제 투여금기 환자 대상에 간질환을 가지고 있거나 경력이 있는 환자가 추가된다.
'디아세레인' 제제 기존 허가사항에는 중증의 간부전 환자가 투여금기 대상이었지만, 간질환을 가지고 있거나 경력이 있는 환자로 확대 반영된다.
'디아세레인' 제제 '신중투여 대상 환자' 항목의 경우 '고령자'에서 '65세 이상의 고령자'로 변경된다.
신설된 '일반적 주의' 항목에 따르면, 디아세레인 투여는 때때로 설사를 일으킬 수 있으며, 이는 탈수와 저칼륨혈증으로 이어질 수 있다. 설사가 발생할 경우 투여를 중단하고 의사의 지시에 따른다. 완화제와의 병용투여는 피해야 한다.
또한, 식약처는 '일반적 주의' 항목에 "간 손상의 징후는 관찰돼야 하며, 간 손상과 관련된 다른 의약품 병용 사용 시 주의가 필요하다. 디아세레인 투여시 알코올 섭취 제한이 추천된다. 간효소 증가 또는 의심되는 징후 또는 간 손상 증상이 발견될 때 투여를 중단하고 의사의 지시에 따른다"는 내용을 추가했다.
이와 함께, 상호작용 항목에는 "이뇨제 병용투여시 탈수와 저칼륨혈증이 발생할 수 있으므로 주의가 필요하다"는 내용이 반영된다.
식약처는 "허가변경 해당 업체는 품목허가증(신고) 원본 이면(변경 및 처분사항 등)에 변경일자, 변경지시 항목 기재, 변경지시(행정지시) 문서번호 및 시행일자 기재 등 후속 조치를 변경 지시일부터 1개월 이내에 이행해야한다"고 밝혔다.
이어 식약처는 "품목허가(신고)증 원본에 변경 지시한 내용(통일조정안)을 첨부한 후 자체 보관·관리해야하며, 해당 기간내에 이행하지 않을 경우, 관련 법령에 따라 행정 조치된다"고 밝혔다.

