'아리피프라졸' 제제의 소아(6~18세) 뚜렛장애에 대한 재심사를 위해 4년 동안 648명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 7.72%(50/648명, 총 65건)로 보고됐다.
이 중 중대한 이상사례의 발현율은 인과관계와 상관없이 0.15%(1/648명, 1건)로 신경염이 보고됐다. 이 약과 인과관계를 배제할 수 없는 중대한 약물이상반응은 보고되지 않았다.
19일 식품의약품안전처에 따르면, 한국오츠카제약의 '아빌리파이정5mg' 등 6품목에 대한 재심사 결과를 토대로 '아리피프라졸' 제제(단일제, 경구제, 재심사 대상 효능․효과: '뚜렛장애')에 대해 허가사항이 변경지시됐다. 허가사항 변경 반영 일자는 오는 25일이다.
식약처는 한국오츠카제약의 '아빌리파이정5mg' 등 '아리피프라졸' 제제 허가사항에 '국내 시판 후 조사 결과'<下 표 참조>를 신설, 반영한다.
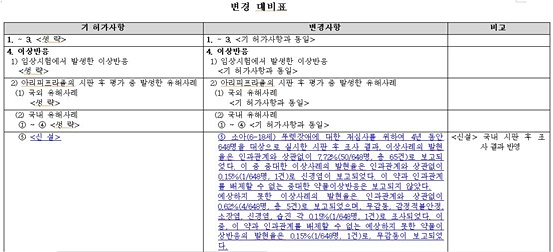
식약처(국내 시판 후 조사결과)에 따르면, 소아(6~18세) '뚜렛장애'에 대한 재심사를 위해 4년 동안 648명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 7.72%(50/648명, 총 65건)로 보고됐다.
이 중 중대한 이상사례의 발현율은 인과관계와 상관없이 0.15%(1/648명, 1건)로 신경염이 보고됐다. 이 약과 인과관계를 배제할 수 없는 중대한 약물이상반응은 보고되지 않았다.
예상하지 못한 이상사례의 발현율은 인과관계와 상관없이 0.62%(4/648명, 총 5건)로 보고됐으며, 무감동, 감정적불안정, 소장염, 신경염, 습진 각 0.15%(1/648명, 1건)로 조사됐다. 이 중, 이 약과 인과관계를 배제할 수 없는 예상하지 못한 약물이상반응의 발현율은 0.15%(1/648명, 1건)로, 무감동이 보고됐다.

