B형 간염 치료제 GSK '제픽스정100mg' 등 라미부딘 성분 제제는 유럽 집행위원회(EC) 안전성 정보와 관련해 국내·외 허가현황 등을 토대로 허가사항이 변경 지시됐다.
B형 간염 치료제 GSK '제픽스정100mg', 대웅제약 '대웅라미부딘정100mg' 등 라미부딘 성분 제제 허가사항 '용법·용량' 항목에 '임상적 내성' 내용이 신설됐다.
8일 식품의약품안전처에 따르면, '약사법' 제76조 제1항 단서 규정, '의약품 등의 안전에 관한 규칙' 제8조 제3항 등 규정에 따라 '라미부딘 성분 제제'에 대한 사용상의 주의사항을 변경토록 지난 1일자로 지시됐다. 허가사항 반영 변경지시일자는 오는 3월 1일자이다.
허가사항 변경지시 대상 품목<파일>은 GSK '제픽스정100mg', 대웅제약 '대웅라미부딘정100mg', 종근당 '벨픽스정', 부광약품 '라미픽스정', 동아에스티(동아ST) '헤파부딘정100mg', 한독 '헵토리버정100mg', 제일약품 '제라픽정100mg', 한미약품 '한미부딘정100mg' 등이다.
식약처는 '라미부딘' 성분제제의 유럽 집행위원회(EC) 안전성 정보와 관련해 국내·외 허가 현황 등을 토대로 허가사항 변경지시(안)을 마련해 의견조회를 실시한 바 있다.
메디컬헤럴드신문이 최근 식약처 '라미부딘 단일제(경구) 허가사항 변경 대비표'<下 표 참조>를 확인한 결과, 용법·용량 항목에 '임상적 내성' 내용이 신설된 것으로 나타났다.
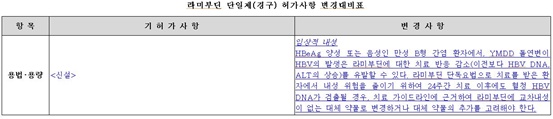
식약처는 허가사항 '용법·용량' 항목에 "HBeAg 양성 또는 음성인 만성 B형 간염 환자에서 YMDD 돌연변이 HBV의 발생은 라미부딘에 대한 치료 반응 감소(이전보다 HBV DNA, ALT의 상승)를 유발할 수 있다"는 내용을 신설했다.
또한, '용법·용량' 허가사항에 "라미부딘 단독요법으로 치료를 받은 환자에서 내성 위험을 줄이기 위해 24주간 치료 이후에도 혈청 HBV DNA가 검출될 경우, 치료 가이드라인에 근거해 라미부딘에 교차내성이 없는 대체 약물로 변경하거나 대체 약물의 추가를 고려해야 한다"는 문구가 신설됐다.
이와 함께, 식약처는 허가사항 '사용상의 주의사항'에 "YMDD 변이 HBV 환자의 경우, 라미부딘에 교차저항을 보이지 않는 대체 약물로 변경하거나 대체 약물의 추가를 고려해야 한다"는문구를 신설했다.
식약처는 관련 단체(협회) 등은 회원사 및 비회원사 등에 널리 전파하고, 의약품 사전·사후 관련 기관(부서) 등에서는 향후 의약품 품목허가(신고수리) 등 민원서류 검토 및 표시기재 사항의 사후관리 등 약사감시 관련 업무에 변경지시 사항을 활용해 줄 것을 당부한다"고 밝혔다.

