식품의약품안전처는 외국 제약사가 국내 제약사에 제제기술을 이전한 재심사 대상 의약품과 희귀의약품 등에 대해서는 국내 제조 시설 없이도 위탁제조판매업 신고로 해당 품목을 허가받을 수 있도록 하는 것을 주요 내용으로 하는 '의약품 등의 안전에 관한 규칙' 개정(안)<下 표 참조>을 입법 예고한다고 밝혔다.
| ※ 위탁제조판매업 신고 : 국내 제조시설을 갖추지 아니하고 식품의약품안전처장으로부터 제조판매품목허가를 받은 의약품을 국내 제조업자에게 위탁해 제조판매하는 영업을 말한다. ※ 재심사: 의약품 허가 후 일정기간(허가일로부터 4∼6년)을 정해 시판 후 약물사용에 따른 안전성·유효성에 관한 자료를 수집·평가하는 제도로 신약, 투여경로 변경(예:주사제→정제) 전문의약품, 유효성분 종류, 배합비율이 다른 전문의약품(예 :단일제→복합제)등이 해당된다. |
이번 개정안은 지난해 10월 개정‧공포된 '약사법'에 대한 하위 법령을 정비하기 위한 것으로 해외 의약품의 우수한 제제기술 이전을 통해 국내 제약산업 경쟁력을 높이기 위해 마련됐다.
개정안 주요 내용은 ▲외국에서 판매되고 있는 의약품 중 위탁제조판매업 신고 대상 확대 ▲‘임상시험’과 ‘생물학적동등성시험’의 실시기준, 준수사항 등을 통합관리 ▲의약외품 표시‧기재사항 강화 등이다.
외국 제약사가 해외에서 판매되는 의약품 가운데 국내 제약사에 제제 기술을 이전한 재심사 대상 의약품 등에 대해서는 국내제약사에 위탁 제조할 수 있도록 함으로써 국내 제약사는 공장 가동율이 증가할 수 있을 것으로 예상된다.
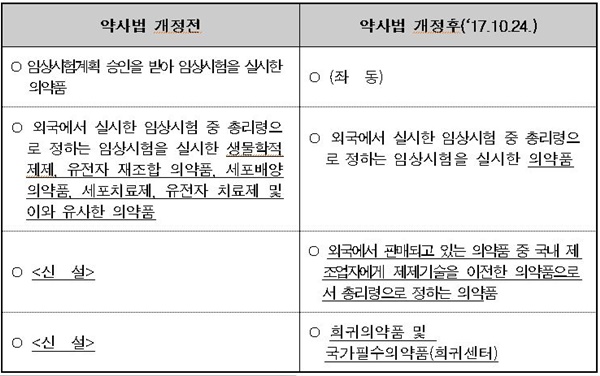
‘생물학적동등성시험’의 경우 그동안 ‘임상시험’과 별도로 실시기준, 준수사항 등을 정해 적용해 왔으나, 앞으로는 임상시험과 통합해 운영함으로써 관리를 효율적으로 개선된다.
의약외품의 첨부문서에 효능·효과, 용법‧용량, 주의사항, 손상 제품에 대한 연락처 또는 교환방법 등 기재를 의무화해 소비자의 알 권리를 강화한다.
식약처는 "이번 개정안을 통해 국내 제약산업의 안정적 성장 기반이 확대되는 계기가 될 것"이라며 "앞으로도 국내 제약산업 강화를 위한 제도적 지원과 함께 우수한 의약품이 공급‧유통되는 환경을 조성하기 위해 최선을 다하겠다"고 밝혔다.

