아스트라제네카(AstraZeneca)와 글로벌 바이오 연구개발 부문 자회사 메드이뮨(MedImmune)은 지난 23일부터 26일까지 국제 폐암연구협회(IASLC, The International Association for the Study of Lung Cancer) 주최로 캐나다 토론토에서 열린 제19회 세계폐암학회(WCLC) 연례학술대회의 프레지덴셜 심포지엄에서 PACIFIC 3상 임상 연구에서 나타난 임핀지(성분명:더발루맙)의 전체 생존 기간(OS, Overall Survival) 결과를 발표했다.
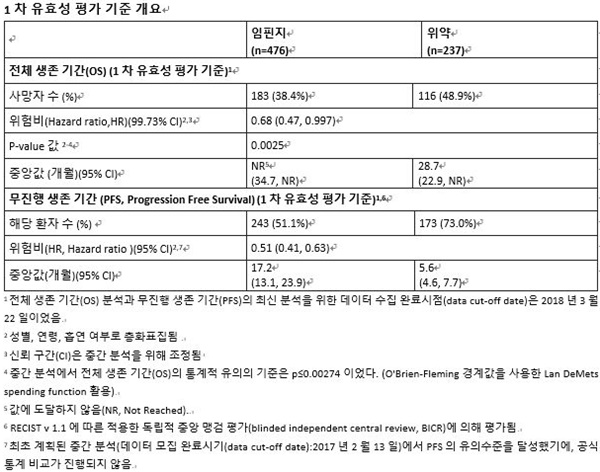
PACIFIC 3상 임상 연구 결과, 임핀지는 PD-L1의 발현과 관계없이 사망 위험을 32% 감소시키며 두 번째 1차 유효성 평가 지표인 전체 생존 기간(OS)을 유의하게 개선한 것으로 나타났다(HR 0.68, 99.73% CI 0.47-0.997; p=0.0025).
해당 연구 결과는 세계폐암학회에서 발표됨과 동시에 뉴잉글랜드 저널 오브 메디슨지(New England Journal of Medicine, NEJM)에 게재됐다.
아스트라제네카의 션 보헨(Sean Bohen) 글로벌 의약품 개발 담당 부사장 겸 의학책임자는 “이번 연구 결과를 통해 임핀지는 항암화학방사선 요법 이후 질병 진행이 되지 않은 수술이 불가한 3기 비소세포폐암 환자에서 전체 생존율을 유의미하게 개선한 최초의 면역항암제임을 입증했다. 이는 지난 수십년간 생존율 개선이 이루어지지 않았던 치료 영역의 환자들에게 새로운 희망이 될 것”이라고 말했다.
PACIFIC 임상을 총괄한 미국 모핏 암 센터 연구소(Moffitt Cancer Center and Research Institute) 흉부종양학과장 스콧 앤토니아(Scott J. Antonia) 박사는 "현재까지 동시 항암화학방사선요법으로 치료 받은 환자들의 5년 생존율은 15%에 불과했다. 이번 PACIFIC 임상 연구에서 확인된 의미 있는 생존 기간 연장은 새로운 표준 치료에 대한 분명한 근거와 확신을 심어준다”고 말했다.
임핀지의 안전성 및 내약성은 무진행 생존기간(PFS) 분석 결과 보고 당시와 같았으며, 위약 대비 임핀지 투여군에서 가장 빈번하게 나타난 이상사례는(20% 이상 환자에서 발생) 기침(35.2% vs. 25.2%), 피로(24.0% vs. 20.5%), 호흡 곤란(22.3 % vs. 23.9), 방사선 폐렴(20.2 % vs.15.8%)이었다.
임핀지 투여군의 30.5%, 위약 투여군의 26.1%가 3 또는 4단계의 이상사례를 경험했으며, 이상사례로 인해 치료가 중단된 경우는 임핀지 투여군과 위약 투여군에서 각각 15.4%, 9.8%로 나타났다.
현재 임핀지는 미국, EU, 캐나다, 스위스, 인도, 일본 및 브라질에서 승인됐으며, 그 외 여러 국가에서 허가 심사 및 서류 제출을 진행하고 있다.

