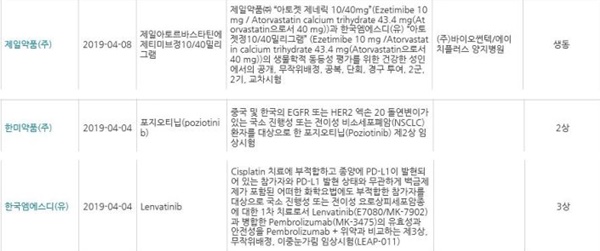
제일약품 '제일아토르바스타틴에제티미브정10/40밀리그램'의 경우, 제일약품 '아토젯 제네릭 10/40mg'(Ezetimibe 10mg/Atorvastatin calcium trihydrate 43.4mg(Atorvastatin으로서 40mg))과 한국엠에스디 '아토젯정10/40밀리그램'(Ezetimibe 10mg/Atorvastatin calcium trihydrate 43.4mg(Atorvastatin 으로서 40mg))의 생물학적 동등성 평가를 위한 건강한 성인에서의 공개, 무작위배정, 공복, 단회, 경구 투여, 2군, 2기, 교차시험 등 생동 임상시험이 승인됐다.
한미약품 '포지오티닙(poziotinib)'의 경우, 중국 및 한국의 EGFR 또는 HER2 엑손 20 돌연변이가 있는 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 환자를 대상으로 한 포지오티닙(Poziotinib) 제2상 임상시험 등 2상 임상시험이 승인됐다.
한국BMS제약 'BMS-986205'의 경우, 근육 침윤성 방광암 대상자에서 선행 화학요법+니볼루맙 또는 니볼루맙과 BMS-986205에 수술 후 계속 이어지는 니볼루맙 또는 니볼루맙과 BMS-986205 요법을 선행 화학요법 단독과 비교하는 제3상, 무작위 배정 임상시험 등 3상 임상시험이 승인된 것으로 나타났다.
본지가 식품의약품안전처의 최근 의약품 임상시험 승인현황<下 표 참조>을 확인한 결과, ▲제일약품 '제일아토르바스타틴에제티미브정10/40밀리그램' 생동, ▲한미약품 '포지오티닙(poziotinib)' 2상, ▲한국MSD 'Lenvatinib' 3상, ▲대웅제약 'DWJ211' 3상, ▲동아에스티 'DA-5207' 1상, ▲한국BMS제약 'BMS-986205' 3상 등으로 임상시험이 승인된 것으로 나타났다.
제일약품 '제일아토르바스타틴에제티미브정10/40밀리그램'의 경우, 제일약품 '아토젯 제네릭 10/40mg'(Ezetimibe 10mg/Atorvastatin calcium trihydrate 43.4mg(Atorvastatin으로서 40mg))과 한국엠에스디 '아토젯정10/40밀리그램'(Ezetimibe 10mg/Atorvastatin calcium trihydrate 43.4mg(Atorvastatin으로서 40mg))의 생물학적 동등성 평가를 위한 건강한 성인에서의 공개, 무작위배정, 공복, 단회, 경구 투여, 2군, 2기, 교차시험 등 생동 임상시험이 승인됐다.
한미약품 '포지오티닙(poziotinib)'의 경우, 중국 및 한국의 EGFR 또는 HER2 엑손 20 돌연변이가 있는 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 환자를 대상으로 한 포지오티닙(Poziotinib) 제2상 임상시험 등 2상 임상시험이 승인됐다.
한국MSD 'Lenvatinib'의 경우, Cisplatin 치료에 부적합하고 종양에 PD-L1이 발현되어 있는 참가자와 PD-L1 발현 상태와 무관하게 백금제제가 포함된 어떠한 화학요법에도 부적합한 참가자를 대상으로 국소 진행성 또는 전이성 요로상피세포암종에 대한 1차 치료로서 Lenvatinib(E7080/MK-7902)과 병합한 Pembrolizumab(MK-3475)의 유효성과 안전성을 Pembrolizumab+위약과 비교하는 제3상, 무작위배정, 이중눈가림 임상시험(LEAP-011) 등 3상 임상시험이 승인됐다.
대웅제약 'DWJ211'의 경우, 중증도 또는 중증의 턱밑 지방 진단을 받은 성인을 대상으로 DWJ211의 유효성 및 안전성을 평가하기 위한 무작위배정, 이중눈가림, 다기관, 위약 대조, 제3상 임상시험 등 3상 임상시험이 승인됐다.
동아에스티 'DA-5207'의 경우 건강한 성인 남성에서 DA-5207 단회 투여 시의 안전성과 내약성 및 약동학적 특성을 평가하기 위한 단일 눈가림, 위약 및 활성약 대조, 평행 설계, 단계적 증량, 제1상 임상시험 등 1상 임상시험이 승인됐다.

한국BMS제약 'BMS-986205'의 경우, 근육 침윤성 방광암 대상자에서 선행 화학요법+니볼루맙 또는 니볼루맙과 BMS-986205에 수술 후 계속 이어지는 니볼루맙 또는 니볼루맙과 BMS-986205 요법을 선행 화학요법 단독과 비교하는 제3상, 무작위 배정 임상시험 등 3상 임상시험이 승인됐다.

