영국 의약품건강관리제품규제청(MHRA)의 '엑세나타이드' 성분제제 안전성 정보에 대한 검토 결과에 따라, 엑세나타이드 성분제제 '사용상의 주의사항' 항목에 "이 약은 인슐린 대체제가 아니다"는 내용이 허가사항에 반영된다.
엑세나타이드 성분 제제 허가사항에 "인슐린 의존성 환자들에게 인슐린을 급격하게 감량하거나 중단한 후 당뇨병성 케톤산증이 보고됐다"는 내용이 신설된다.
식품의약품안전처는 최근 영국 의약품건강관리제품규제청(MHRA)의 '엑세나타이드' 성분제제 안전성 정보에 대한 검토 결과에 따라 품목에 대한 허가 변경이 필요하다고 판단되어 허가사항 변경(안)을 마련했다고 밝혔다.
엑세나타이드 성분제제 허가변경 대상<下 파일 참조> 품목은 한국아스트라제네카 '바이에타펜주10마이크로그램' 등 2개 품목이다.
본지가 식약처 '엑세나타이드 성분제제 변경대비표'<下 표 참조>를 확인한 결과, '사용상의 주의사항' 항목에 "이 약은 인슐린 대체제가 아니다. 인슐린 의존성 환자들에게 인슐린을 급격하게 감량하거나 중단한 후 당뇨병성 케톤산증이 보고됐다"는 내용이 신설된 것으로 나타났다.
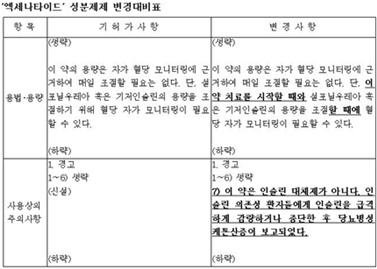
식약처는 엑세나타이드 성분제제 '용법·용량' 항목의 경우, "이 약 치료를 시작할 때와 설포닐우레아 혹은 기저인슐린의 용량을 조절할 때에 혈당 자가 모니터링이 필요할 수 있다"는 내용으로 변경했다.
엑세나타이드 성분제제 변경안에 따르면, 사용상의 주의사항 항목에 "이 약은 인슐린 대체제가 아니다. 인슐린 의존성 환자들에게 인슐린을 급격하게 감량하거나 중단한 후 당뇨병성 케톤산증이 보고됐다"는 내용이 신설됐다.

