식품의약품안전처는 국내에서 엘러간社 유방 보형물을 이식 받은 환자에게서 역형성 대세포 림프종(BIA-ALCL)이 발생함에 따라, 유방 보형물에 대한 안전관리 강화 대책을 마련했다고 28일 밝혔다.
| ※유방 보형물 연관 역형성 대세포 림프종(BIA-ALCL: Breast Implant Associated - Anaplastic Large Cell Lymphoma)은 면역체계와 관련된 희귀 암의 한 종류로 유방암과는 별개의 질환임. 의심 증상으로는 장액종으로 인한 유방 크기 변화, 피막에 발생한 덩어리나 피부 발진 등이 있다. ※ 장액종 : 조직액이 특정 장소에 고여서 덩어리처럼 만져지는 것 |
엘러간社 유방보형물 이식환자에 대한 안전대책은 ▲ 신속한 환자 파악 ▲ 안전성 정보 제공 ▲ 전담사이트 및 콜센터 운영 ▲ 부작용 환자 추적 관리 ▲ 보상방안 등이다.
의료기관을 통해 엘러간社 거친 표면 제품이 사용된 환자현황을 제출하도록 하고, 폐업 의료기관의 경우 보건소 협조를 통해 이식환자를 파악할 계획이다.
추적관리시스템에 등록된 520개 의료기관 등으로 하여금 환자사용현황을 제출하도록 했다.
이번에 배포하는 안전성 정보에 대해 성형 외과전문의 외에도 종양학, 병리학, 역학 등 다양한 분야의 전문가와 함께 논의해 확정했다.
환자를 대상으로는 불필요한 불안감을 해소하기 BIA-ALCL 발생비율, 예방적 제거에 따른 위험, 의심 증상, 조기진단 및 치료를 위한 정기검진 주기, 권역별 집중 의료기관 등 대처요령을 추가 제공했다.
의료인을 대상으로는 BIA-ALCL 의심 증상 환자에 대한 진단절차와 확진 시 치료방법에 대한 정보와 함께 의료기관 조치절차를 제공했다.
| ▪ [환자] ▴증상이 없을 경우 예방 차원의 제거는 권고하지 않음(발생비율, 예방적 제거의 위험 포함) ▴유방 크기의 변화, 딱딱한 덩어리 만져짐, 피부에 궤양, 발적이 생기는 등 의심증상이 있을 경우 의료기관을 방문 검사 ▴이식한지 1년 후 1회/년 정기검진 ▴집중관리 의료기관(41개소) 안내 ▪ [의료인] (진단관련)▴확진시까지 수술적 치료는 보류 ▴확진을 위해 장액(최소 20~50cc) 또는 조직 채취 후 병리검사 실시 (치료관련) ▴종양이 림프절이나 다른 조직으로 전이되지 않은 국소단계에서는 병변과 보형물 및 피막을 완전히 제거하는 것만으로 완치 가능 ▴전이가 일어난 경우에는 항암 요법 및 방사선 요법 시행 ▴집중관리 의료기관(41개소) 및 병리검사 의뢰기관(삼광의료재단, 37개소) 안내 |
안전성 정보제공의 경우, 의료기관으로 하여금 개별 환자에게 안전성 정보를 제공토록 할 계획이다. 우선적으로 파악된 대상 환자에게 개별 통보하도록 하고 그 결과를 증빙자료와 함께 식약처에 매주 보고하도록 하겠다고 밝혔다.
식약처는 의료기관의 환자통보결과를 점검하고 개별 통보가 신속하게 이루어지도록 적극 독려하도록 하겠다고 했다.
식약처는 유방 보형물 이식 환자가 안전성 정보 등을 보다 쉽게 확인할 수 있도록 '엘러간社 거친 표면 유방보형물 이식환자를 위한 종합안내' 사이트를 식약처 홈페이지에 새롭게 개설했다.
대한성형외과학회와 엘러간社 홈페이지와도 연결해 질의응답, 안전성 정보, 이상증상, 대처요령 및 검진기관을 안내하도록 했다. 또한, 개인 맞춤형 전문 상담을 위해 전담콜센터를 마련했다.
아울러, 대한성형외과학회, 병리학 등 종양전문가와 공동으로 BIA-ALCL 안전성 정보 관련 동영상을 제작해 유튜브 등에 게재하고, 유방암 및 성형관련 인터넷카페(120만명 회원 대상) 등 온라인 매체를 적극 활용해 홍보를 강화할 계획이다.
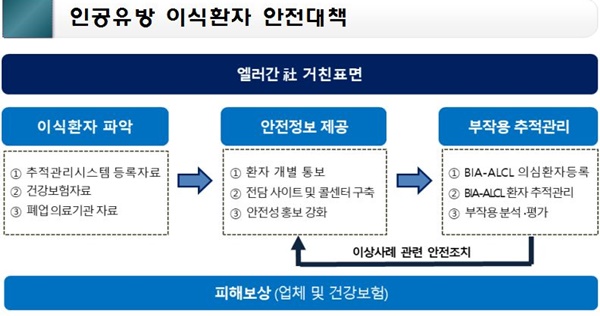
부작용 추적 관리의 경우, 지난 8월 28일부터 BIA-ALCL 의심환자를 별도로 등록해 부작용 환자 추적관리를 시작했다. BIA-ALCL 의심증상이 있는 환자가 의료기관을 방문하면, 의료인이 해당 환자를 한국의료기기안전정보원에 등록하고 검진결과를 모니터링한다.
확진 환자인 경우 수술내역, 제품정보 등 추적관리와 동시에 보상프로그램과 연계해 관리할 예정이며, 확진 환자가 아닌 경우 지속적인 부작용을 분석‧평가할 계획이다. 추가적으로 건강보험청구자료 등을 이용해 유방보형물을 이용한 재건환자의 부작용을 조사한다.
아울러, 2020년부터는 의료기관 및 제조‧수입업체와 함께 전체 유방보형물 이식환자 BIA-ALCL 이외의 부작용도 모니터링할 계획이다.
보상방안의 경우, 현재 BIA-ALCL 확진, 의심, 예방차원의 단계별 보상대책을 엘러간社에 제출 요구했다. 수술비, 치료비 등 보상대책을 업체가 제출(8월 30일 예정)하면 업체가 제시한 보상대책을 복지부 등 관련부처와 협의 검토한 후 9월중 최종 확정할 예정이다.
엘러간社 외의 거친 표면 유방보형물 안전조치와 관련해 국내 BIA-ALCL 발생사례가 없으나, 외국의 다양한 정보에 따르면 주로 거친 표면 제품에서 BIA-ALCL이 발생하고 있음을 고려해 부작용 예방 차원에서 사전적 조치로 8월 29일부터 의료기관에 사용 중지하도록 요청했다.
식약처는 "유방 보형물을 이식한 환자분들의 불안 및 우려 등을 최소화하고, BIA-ALCL 조기 발견 및 적절한 치료를 받을 수 있도록 앞으로도 최선을 다하겠다"고 밝혔다.