'제네릭 의약품 약가 산정 기준 개편'의 경우, 차등가격 적용을 위한 기준요건(자체 생물학적동등성시험자료 또는 임상시험 입증자료 제출 및 등록된 원료의약품 사용)이 신설된다.
동일 제제가 19개 제품이하로 등재되어 있는 경우, 기준 요건 충족 수준(모두충족, 1개만 충족, 충족 요건 없음)에 따라 각각 최초 등재 제품 상한금액의 53.55%, 45.52%, 38.69%로 산정된다.
동일제제가 20개 이상 제품이 등재되어 있는 경우 동일제제 상한금액 중 최저가와 38.69%로 산정되는 금액 중 낮은 금액의 85%로 산정된다.
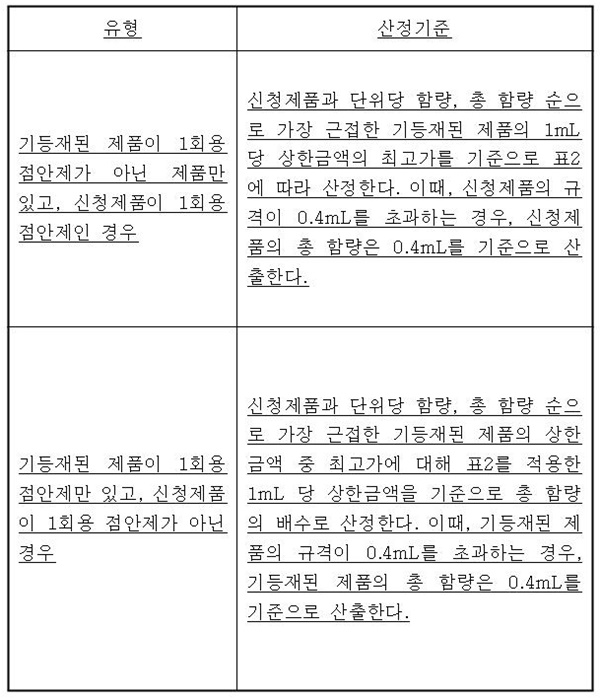
기등재된 제품이 다회용 또는 1회용만 있는 점안제이나 신청제품이 1회용 또는 다회용인 경우의 산정기준이 신설된다.
개량신약(개량신약복합제 포함)의 경우, 개량신약 또는 개량신약을 구성하는 개별 단일제 또는 복합제와 투여경로·성분·제형이 동일한 제품이 등재될 때까지 가산이 유지된다.
보건복지부는 28일 '약제의 결정 및 조정 기준 일부 개정고시안'을 재행정 예고했다.
복지부는 "지난해 3월 정부가 발표한 '복제(제네릭) 의약품 약가제도 개편방안'을 구체화해 복제(제네릭) 의약품의 가격을 기준요건 충족 여부에 따라 차등 산정하는 세부 기준을 마련했다"고 밝혔다.
복지부는 "기등재된 제품이 다회용 또는 1회용만 있는 점안제의 신청제품이 1회용 또는 다회용인 경우의 산정 기준 신설 및 가산제도를 개편하는 등 차등 산정으로의 제도 개편과 현재 제도 운영상 나타난 일부 미비점을 보완하려는 것"이라고 설명했다.
◆'제네릭 의약품 약가 산정 기준' 개편= 복지부 '재행정 예고안'에 따르면, '복제(제네릭) 의약품 약가 산정 기준 개편'<下 표 참조>에서 차등가격 적용을 위한 기준요건(자체 생물학적동등성시험자료 또는 임상시험 입증자료 제출 및 등록된 원료의약품 사용)을 신설됐다.
동일제제가 19개 제품이하로 등재되어 있는 경우, 기준 요건 충족 수준(모두충족, 1개만 충족, 충족 요건 없음)에 따라 각각 최초 등재제품 상한금액의 53.55%, 45.52%, 38.69%로 산정된다.

동일제제가 20개 이상 제품이 등재되어 있는 경우 동일제제 상한금액 중 최저가와 38.69%로 산정되는 금액 중 낮은 금액의 85%로 산정된다.
◆기등재된 제품이 다회용 또는 1회용만 있는 점안제이나 신청제품이 1회용 또는 다회용인 경우의 산정기준이 신설됐다.<下 표 참조>
◆가산제도 개편= 재행정 예고안에는 '가산제도 개편'의 내용이 포함됐다. 기준요건을 모두 충족하는 경우에만 약가 가산 적용된다. 합성․생물의약품의 가산기간을 모두 1년으로 하고, 회사수가 3개사 이하인 경우 가산유지 기간을 모두 최대 2년까지로 했다.
제약사에서 가산기간 연장을 원하는 경우 약제급여평가위원회의 심의를 거쳐 2년 한도 내에서 가산비율 조정 및 가산기간을 연장할 수 있다.
개량신약(개량신약복합제 포함)의 경우, 개량신약 또는 개량신약을 구성하는 개별 단일제 또는 복합제와 투여경로·성분·제형이 동일한 제품이 등재될 때까지 가산이 유지된다.

