식품의약품안전처(처장 이의경)는 코로나19 치료제 개발 시 임상단계 진입을 촉진하고 시행착오를 줄이기 위해 지난 4월 '코로나19 치료제 개발 시 고려사항'(지침)을 발간했다고 28일 밝혔다.
이번 지침은 임상시험을 위한 제출자료 및 요건을 다룬 것으로 ▴항바이러스제, 항염증제 등 작용기전에 따른 효력시험방법 및 사례 ▴필요한 독성시험자료 종류 ▴시험대상자, 평가항목 등 임상시험 설계 시 고려사항을 담고 있다.
이후 추가로 수집된 국내·외 임상시험 정보와 외국 규제기관의 가이드라인 등을 반영해 동 지침을 개정하게 됐다.
| 이번 개정 내용은 ▴예방 및 치료효과 확인 임상시험에 대한 고려사항 추가 ▴임상시험 평가변수 구체화 ▴연령 등 통계분석 시 결과에 영향을 줄 수 있는 항목은 하위분석 권고 ▴‘독립적 자료 모니터링 위원회’를 통한 안전성‧무용성 분석 등을 추가했다. |
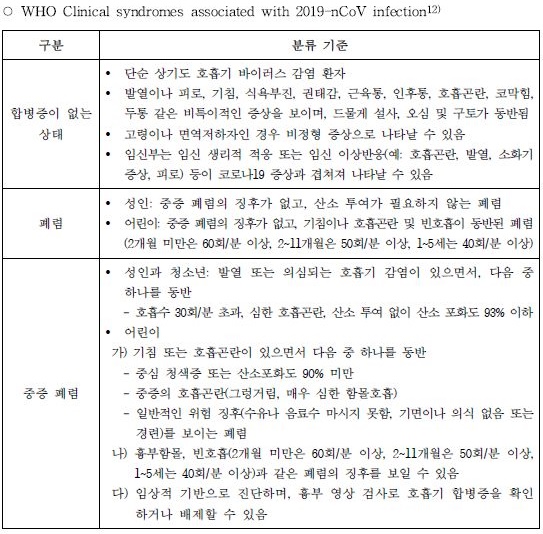
또한, 환자 수 감소로 임상 시험에 어려움을 호소함에 따라 다국가 임상시험을 계획하고 있는 개발자를 위해 WHO 및 미국 FDA의 질병 중증도 분류 기준도 부록에 첨부했다.
아울러, 식약처는 코로나19 치료제·백신의 신속한 제품화를 위한 '고(GO)·신속 프로그램'의 일환으로 '코로나19 전담 상담창구'와 가능성이 높은 품목에 대한 '전담관리자'를 지정·운영하고 있으며, 현재까지 이 프로그램을 통해 24개 업체와 맞춤형 상담을 통해 임상시험 진입에 도움을 주었다.
코로나19 치료제로 임상시험 승인된 12건의 평균 심사일수는 7일 이내이다.
식약처는 "앞으로도 정부 관계기관과 산업계, 학계, 의료계 등과 협력해 치료제와 백신을 기다리는 국민을 위해 안전하고 효과 있는 치료제가 신속히 개발될 수 있도록 최선을 다하겠다"고 밝혔다.