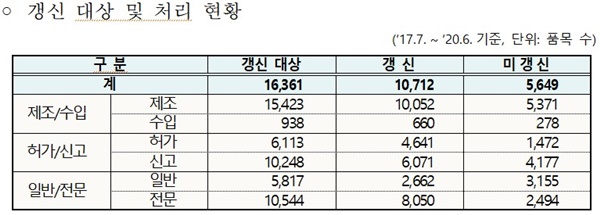
식품의약품안전처(처장 이의경)는 의약품 품목 갱신이 본격 시행된 2018년 이후 올해 6월까지 갱신 대상 품목 16,361개 중 35%를 정비해 10,712개(전체의 65%) 품목이 갱신됐다고 25일 밝혔다.
갱신 대상 의약품은 총 46,063개(‘19.12월 기준) 품목이며, 산술적으로 매년 약 7천여 개 품목을 갱신 대상으로 하고 있다.
의약품 허가‧신고 유효기간을 5년으로 정한 '의약품 품목허가(신고) 갱신제도'는 의약품의 주기적‧체계적인 안전관리를 위해 2013년 도입되어 2018년부터 본격적으로 시행하고 있다.
| * 갱신 제출자료 : '의약품 등의 안전에 관한 규칙' 제20조에 따른 유효기간 동안 수집된 안전관리 자료, 외국 사용현황 자료 및 제조‧수입실적 등 |
허가 갱신을 통해 품목이 정비된 주요 사유는 생산·수입 실적이 없는 경우가 64%(3,612개)로 많았다.
아울러, ▲수입보다 제조 품목이 대부분을 차지(95%, 5,371개)했고, ▲허가 품목(26%, 1,472개)보다는 신고 품목(74%, 4,177개)이 ▲전문의약품보다는 일반의약품 비율이 높았다.
식약처는 "지난 3년간 운영해온 의약품 품목 갱신의 주요 성과로는 허가만 받고 생산‧수입하지 않은 상당수 품목을 정비함으로써 소비자에게 실제 공급·사용되는 의약품을 중심으로 효율적인 안전관리를 할 수 있는 기반을 마련했다는 데 의의가 있다"고 밝혔다.
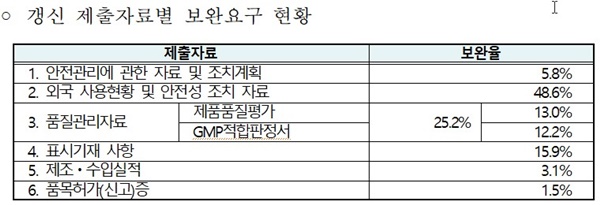
한편, 민관협의체 등 업계와 지속적으로 소통하여 갱신을 위한 자료보완을 요구한 품목의 비율이 올해 30%까지 낮아다.
식약처는 "갱신제도가 의약품의 시판 후 안전 및 품질 관리 현황을 주기적으로 확인할 수 있는 제도로 자리매김할 수 있도록 지속적으로 개선을 추진하고 있다"고 밝혔다.
내년 3월부터는 안전관리에 관한 자료로서 제약업체 내 시판 후 안전관리를 담당하는 안전관리책임자의 분석‧평가 결과 제출을 의무화하고, 관련 안전성 정보 보고자료 일체도 함께 제출하도록 개선된다.
식약처는 "앞으로도 의약품 갱신제도를 통해 국민께 안전과 품질이 확보된 의약품이 공급될 수 있도록 최선을 다하겠다"고 밝혔다.

