식품의약품안전처(처장 김강립)는 의약품 재심사의 객관성·정확성 확보를 위한 적정규모의 조사대상자수 산출 방법을 구체적으로 안내하는 내용으로 '신약 등의 재심사 업무 가이드라인'을 11월 18일 개정·배포했다고 밝혔다.
주요 개정 내용은 ▲시판 후 조사의 적정 조사대상자수를 선정하기 위한 산출 방법과 사례 제시 ▲정기 보고로 제출 가능한 경미한 변경사항 범위 확대이다.
특히 지난 2020년 12월 '신약 등의 재심사 기준' 개정 시 ‘고정 조사대상자 수’가 삭제됨에 따라 품목별로 적정한 조사대상자 수를 선정하기 위한 산출 방법과 자료작성 사례를 신설했다.
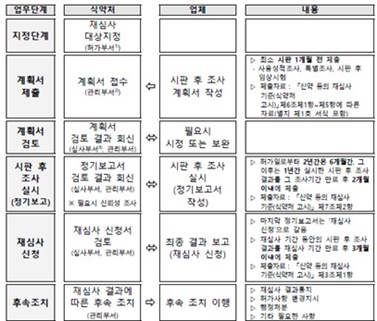
또한, 여러 업체가 시판 후 조사 등을 공동으로 시행하는 경우, 업체명, 제품명 등 경미한 변경은 별도의 변경 허가 없이 정기 보고로 제출할 수 있도록 개정했다.
의약품 재심사 제도란 신약 또는 일부 전문의약품에 대해 허가 후 일정 기간 부작용 등을 조사해 안전성·유효성을 재심사하는 제도이다.
식약처는 "이번 가이드라인 개정이 의약품의 시판 후 안전관리 수준을 높이고 의약품을 안전하게 사용하는 환경을 조성하는데 도움을 줄 것으로 기대하며, 앞으로도 규제과학을 기반으로 시판 후 안전관리 제도를 합리적으로 운영하겠다"고 밝혔다.

