보건당국이 GSK社가 자체적으로 허가 관련 문서보완 등을 위해 최근 자사 백신(9종, 이중 국가예방접종 백신 7종)의 국내 출하를 일시 중지함에 따라, 국가예방접종사업의 차질 없는 수행을 위한 대체 백신에 관한 실시 기준을 마련했다.
질병관리청은 GSK社가 자체적으로 허가 관련 문서보완 등을 위해 지난 10월 26일부터 자사 백신(9종, 이중 국가예방접종 백신 7종)의 국내 출하를 일시 중지함에 따라 국가예방접종사업의 차질 없는 수행을 위한 대체 백신에 관한 실시기준을 마련해 지자체 및 의료계에 안내했다고 지난 18일 밝혔다.
GSK는 국제공통기술문서 현행화 작업 중 발견한 문서기재 사항 오류 보완을 위해 식품의약품안전처에 잠정 국내 출하 정지 신청했으며, 변경 허가를 받은 후에 공급 재개할 예정이다.
질병관리청은 현재 의료기관 등 접종 현장에서 보유하고 있는 GSK社 백신에 대한 사용방침을 지난 10월 28일에 전국 시군구 보건소 및 의료계에 안내한 바 있다.
신규 1차 접종 시에는 GSK社 백신을 사용하지 않고 다른 제약사 백신을 우선 접종하고, GSK社 백신 보유분은 GSK社 백신으로 접종을 시작한 경우 이후 접종에만 접종 권고하고 있다.
또한, GSK社의 동일백신으로 추가접종이 불가능한 경우를 대비해 다른 제약사의 백신으로 교차 접종 가능 여부를 국외 사례조사, 전문가 검토 및 예방접종전문위원회의 심의(11.12.)를 거쳐 실시기준을 마련했다(GSK社 백신 공급 재개 전에 한함).
이번에 공급이 중단된 GSK社 백신 중 홍역‧유행성이하선염‧풍진(MMR) 백신과 A형간염 백신은 다른 제약사 백신과 교차접종이 가능하지만, 디프테리아, 파상풍, 백일해(DTaP) 기초접종, 폐렴구균(PCV), 사람유두종바이러스 감염증(HPV) 백신은 원칙적으로 동일 제조사 백신으로 접종완료하는 것을 권장하고 있다.
그러나, 예방접종전문위원회는 백신공급 중단 등 불가피한 경우 접종 지연보다는 교차접종으로 접종을 완료하는 것이 이득이 크므로, GSK社 백신으로 기접종자 중 추가접종이 필요한 경우, 가급적 의료기관이 보유 중인 GSK社의 동일백신을 사용하되, 동일백신이 없는 경우 다른 제약사의 대체백신으로 접종하도록 권고했다.
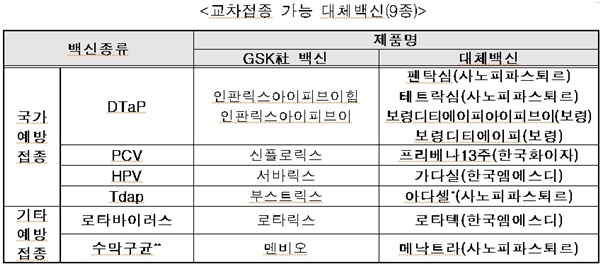
교차 접종 가능 대체 백신(9종)<표 참조>을 보면, ▲DTaP의 경우, 대체 백신은 펜탁심(사노피파스퇴르), 테트락심(사노피파스퇴르), 보령디티에이피아이피브이(보령), 보령디티에이피(보령) 등이 해당된다.
▲PCV의 경우, 대체 백신은 프리베나13주(한국화이자), ▲HPV의 경우 대체 백신은 가다실(한국엠에스디·한국MSD), ▲Tdap의 경우, 대체백신은 아다셀(사노피파스퇴르), ▲로타바이러스의 경우, 대체 백신은 로타텍(한국엠에스디), ▲수막구균의 경우, 대체 백신은 메낙트라(사노피파스퇴르) 등이 해당된다.
질병관리청은 "이번 GSK社의 국가예방접종백신 공급중단과 관련, 백신 제조(수입)사들과의 개별 간담회를 개최해 대부분의 백신은 내년 상반기까지 수급이 안정될 것으로 예상되지만, 단기적으로 일부 부족이 있을 수 있는 백신은 국내 수입을 조속히 조치해 줄 것을 요청했으며, 향후 관계부처 및 백신 제조(수입)사 등과 긴밀한 정보공유 및 업무협조를 해나가겠다"고 밝혔다.

