식품의약품안전처(처장 오유경)는 2일 의약품과 의약외품 허가심사에 대한 투명성, 일관성, 신뢰성을 강화하기 위해 지난 11월에 의약품 9개, 의약외품 1개 총 10개 품목(신규 허가 6개, 변경 허가 4개)의 허가심사 결과(허가보고서)를 순차적으로 공개했다.
| ※ 공개 근거: 「약사법」 제88조의2, 「의약품 등의 안전에 관한 규칙」(총리령) 제102조의 8 공개 대상: ▲신약 ▲자료제출의약품 ▲안전성·유효성 심사대상 의약외품 |
이번에 허가보고서가 공개된 대표적인 의약품은 ▲피부 T-세포 림프종 치료 신약 ‘포텔리지오주20밀리그램(모가물리주맙)’과 ▲황반변성 치료제인 ‘라니비주맙’ 제제에 대해 국내에서 두 번째로 개발된 동등생물의약품(바이오시밀러)인 ‘루센비에스주10밀리그램/밀리리터(라니비주맙)’(종근당)가 있다.
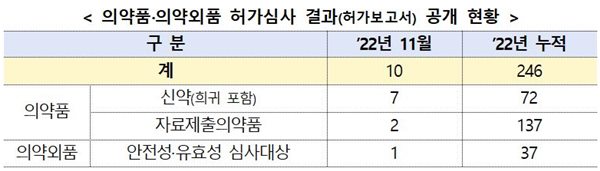
식약처 ‘의약품 허가심사 결과 공개 목록’(2022년 11월 허가심사 결과 공개 목록)에 따르면, 신규 허가의 경우, ‘폰보리정’(포네시모드)(한국얀센), ‘젭젤카주’(러비넥테딘)(보령)(구 보령제약), ‘리브타요주’(세미플리맙)(사노피-아벤티스코리아), ‘루센비에스주10밀리그램/밀리리터’(라니비주맙)(종근당) 등이 포함됐다.
변경 허가의 경우, ‘키트루다주’(펨브롤리주맙,유전자재조합)(한국엠에스디)(한국MSD), ‘코센틱스프리필드시린지’(세쿠키누맙,유전자재조합)(한국노바티스) 등이 포함됐다.
식약처는 “앞으로도 의약품과 의약외품의 허가심사 결과를 공개하고, 매월 공개 목록을 제공함으로써 제약업계의 제품 연구·개발에 도움이 될 수 있도록 노력하겠다”고 밝혔다

