식품의약품안전처(처장 김강립)는 해외제조소 등록, 코로나19 백신 국가출하승인 등 관련 수수료를 신설하는 내용을 담은 '의약품 등의 허가 등에 관한 수수료 규정'(식약처 고시)을 10월 21일 개정고시하고, 10월 24일부터 적용한다고 밝혔다.
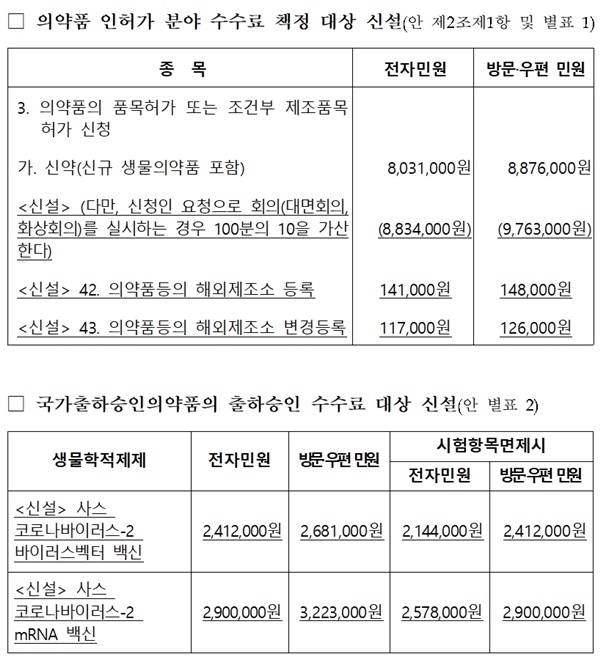
이번에 신설한 주요 수수료 종목(전자민원 기준)은 ▲의약품 등 해외제조소 등록 신청 민원 수수료(14만 1,000원) ▲신약 품목허가 신청 후 회의 실시 수수료(80만 3,000원) ▲코로나19 백신 국가출하승인 수수료이다.
이번에 신설된 수수료는 의약품 허가 분야에 새롭게 도입된 제도의 적정한 운영을 위해 마련됐다.
식약처는 "이번 허가 등 수수료 신설이 의약품 등 해외제조소 등록제도, 코로나19 백신 국가출하승인 업무의 안정적 운영과 안전·품질이 확보된 의약품을 허가하는데 도움이 될 것으로 기대한다"며 "앞으로도 의약품 허가 수준을 높이기 위해 규제과학을 바탕으로 적정 수준의 수수료를 산정·운영하도록 지속적으로 노력하겠다"고 밝혔다.