식품의약품안전처(처장 오유경)는 의약품 시판 후 안전관리에 대한 주요 법령 정보를 제공하고 약물감시에서 수집된 안전성 정보에 대한 조치사례 등을 종합적으로 안내하기 위한 ‘2023년 의약품 안전성 정보 종합 보고서(제3호)’(이하 종합 보고서)를 발간한다고 2월 29일 밝혔다.
이번 종합 보고서에는 ▲시판 후 안전관리 관련 법령 제‧개정 사항 ▲의약품 안전조치 사례(서한 배포 및 허가사항 변경명령) ▲의약품 안전 사용 서비스(DUR)* 변경 현황 등 지난해 식약처가 조치한 의약품 안전 관련 내용 전반을 담았다.
* 의약품 안전 사용 서비스(Drug Utilization Review) : 함께 먹으면 부작용이 발생하거나, 특정 환자(임부 등)에 부작용 발생 우려가 있는 의약품 정보를 의·약사에게 실시간 제공
종합 보고서에는 지난해 변경된 사항을 쉽게 찾아볼 수 있도록 종전 총리령에서 식약처 공고로 개정된 ‘의약품등 이상사례·약물이상반응 보고 서식’과 '공중보건 위기대응 의료제품의 안전사용 조치 및 부작용 보고 등에 관한 규칙'(총리령) 제정(안) 등 관련 법령 정보를 수록했다.
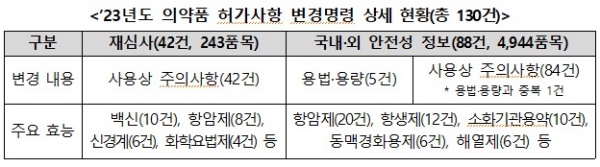
아울러 국민 보건에 영향을 줄 수 있어 긴급 배포한 ‘의약품 정보 서한*’ 6건(10개 성분, 331개 품목)과 신약 등의 재심사 결과를 반영하거나 제품 사용 시 주의사항 등 추가를 위해 허가사항 변경 명령**한 사례 130건(5,187개 품목)의 상세 내용을 담아 성분별 안전성 정보를 참고할 수 있도록 했다.
* (의약품 정보 서한) 임상재평가 결과에 따라 ‘옥시라세탐’(인지장애‧치매), ‘세프테졸나트륨’(항생제) 제제의 사용 중지 권고 등
** (허가사항 변경) ‘소포스부비르(경구제, C형 간염)’ 성분 등 재심사(42건), ‘세푸록심(경구‧주사, 항생제)’에 중증피부이상반응(SCAR) 이상사례 추가 등 사용상 주의사항 변경 등(88건)
그 밖에도 의료현장에서 처방·조제 시 사용하는 의약품 안전 사용 서비스(DUR)의 금기 및 주의 성분 추가‧삭제 등에 지난해 변경 사항에 대한 정보를 포함하고 있다.
식약처는 "이번에 종합 보고서가 업계와 의·약 전문가의 시판 후 안전관리와 약물 안전사용 등 업무에 효율적으로 활용될 것으로 기대하며, 앞으로도 국내‧외 의약품 부작용 등 정보를 적극 수집하고 규제과학 전문성을 바탕으로 신속하게 안전조치를 지속해 나가겠다"고 밝혔다.